计算机化系统验证(CSV)咨询服务
服务背景
20世纪初发展至今,计算机系统在制药行业的应用不断扩大,美国、欧盟、日本、英国、中国等均相继颁布计算机化系统相关的法规要求,随着制药4.0概念的不断深化,制药企业信息化建设提上新的高度,2020年12月1日,中国《药品记录与数据管理要求(试行)》发布,标志着中国对于数据可靠性的要求也越来越高,但由于信息化系统的专业性、技术性的限制,信息化系统建设过程的合规性控制还面临着很大挑战。
制药设备计算机化系统验证的痛点
在制药及医疗器械等生命健康行业,合规性要求是企业的生命线,随着信息技术的不断发展,企业自动化的水平在逐步地提高,在生产过程中运用到了越来越多的计算机化系统,计算机化系统验证(CSV)的标准与要求也在持续更新并趋向规范。在强合规监管下如何全面有效地落实CSV,是所有企业必须要解决的难题。随着监管力度的加强和新版中国GMP的实施,特别是国家药监总局发布GMP规范(2010年修订)计算机化系统和确认与验证两个附录的公告(2015年第54号),对制药企业计算机系统验证提出了更高的要求,明确了计算机系统验证应该贯穿于计算机化系统生命周期的全过程。
辛格迪CSV咨询服务:助力企业合规与数字化转型
计算机化系统在制药及医疗器械等生命健康行业的应用日益广泛,从生产控制到质量管理,再到数据记录与分析,这些系统已成为企业运营的核心组成部分。然而,随着法规要求的日益严格,企业必须确保这些系统不仅高效运行,还要符合严格的合规标准。辛格迪作为生命健康领域的质量合规专家,提供的计算机化系统验证(CSV)咨询服务正是为了解决这一需求。
什么是计算机化系统验证(CSV)?
计算机化系统验证(CSV)是一种全面的验证过程,旨在确保计算机化系统在满足预期性能和规范的同时,符合法规要求和质量标准。CSV涵盖了从验证计划(VP)到用户需求规范(URS)、风险评估(RA)、设计确认(DQ)、安装/运行/性能确认(IQ/OQ/PQ)以及最终的验证报告(TRM)等多个环节。
法规/指南背景
国内外关于制药装备计算机化系统验证尚未有统一的技术标准,国外ISPE GAMP5(Good Automated Manufacturing Practice-Rev5良好自动化生产实践指南第五版)作为制药行业计算机化系统良好的实践指南,一直在潜移默化地影响着各个药企的计算机化系统质量管理活动。目前国家对于数据完整性越来越重视,已经有多个国家/组织已经将计算机化系统作为单独的附录发布。我国在2015年5月,正式颁布了关于计算机化系统和确认与验证这两个附录,并且在2015年12月1日,对制药企业计算机系统验证提出了更高的要求,明确了计算机系统验证应该贯穿于计算机化系统生命周期的全过程。在中国药企进入国际市场时,需要提高验证水平。而国内制药企业在计算机验证时,可供参考的实际案例较为缺乏,系统验证管理水平还较低,部分国内药企做得却参差不齐,不够深入,一个“符合要求”就“完美的”解决了CSV验证。因此,明确计算机验证的流程和方法,尽快提升计算机验证水平,是包括制药和医疗器械在内的所有生命健康企业亟待解决的问题。相关法规列示如下:
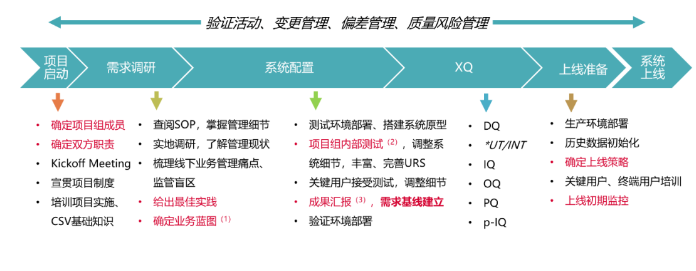
辛格迪的CSV服务内容
辛格迪提供的CSV服务模块化且全面,能够根据客户的具体需求定制验证方案。服务内容包括但不限于:
此外,辛格迪还提供针对各类系统的验证服务,包括QMS、LIMS、ERP、WMS、MES等,确保这些系统在满足业务需求的同时,符合国内外法规要求。
辛格迪的CSV服务的优势
应用场景
辛格迪的CSV咨询服务广泛应用于制药、医疗器械和食品等生命健康行业,尤其适用于以下场景:
团队背景
成员拥有美国专业项目管理PMP认证、IBM/CPM认证等资格,确保以GxP及GAMP5的最佳实践为指导,提供产品全生命周期的测试管理服务,通过CSV验证确保系统稳定可靠的运行,符合法规要求,进而确保和提高产品质量和安全水平。